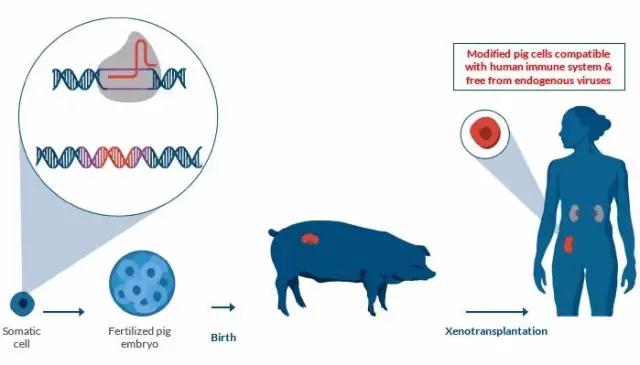
器官移植供体短缺是全世界共同面临的问题:中国是全球器官捐献率最低的国家之一,而在美国,每天都有约 22 人在等待合适的器官中死去。有一种方法被认为能有效解决这一问题,那就是异种器官移植(xenotransplantation):将动物器官移植到人体内。
其中一个被看好的器官来源就是猪。虽然“全身都是宝”,但猪的基因组中却有一个备受关注的潜在威胁——猪内源性逆转录病毒(porcine endogenous retroviruses, PERV),人类细胞具有被这种病毒感染的风险。

 图丨首批出生时DNA中不含 PERV的小猪
图丨首批出生时DNA中不含 PERV的小猪
不过,最新的好消息是,猪器官的人类移植变得更加安全了,因为科学家们已经从根本上成功“团灭”PERV!
今日,《科学》杂志在线刊登了一项重量级的研究。来自浙江大学、云南农业大学、重庆第三军医大学、哈佛大学以及其他科研机构与公司的团队使用CRISPR-Cas9基因编辑技术,一举解决了将猪器官移植到人体内的关键难题。这项研究的通讯作者是2017全球青年领袖,80后科学家杨璐菡博士。


图丨杨璐菡
数十年来,异种器官移植一直被视作缓解人类器官供应短缺的可能途径,外科医生也一直在尝试将动物的器官移植到人体。
但几乎所有的尝试都以失败告终,女婴菲伊(Baby Fae)就是其中非常著名的一例。1984年,女婴菲伊接受了狒狒的心脏移植,20天后死亡。
尽管亲缘关系接近,由于灵长类动物每胎产仔少,成熟周期长,不能满足大量的科研及移植需求。而猪繁殖快,易于饲养,极大地降低了科研成本,更重要的是,无论从解剖学还是生理学指标上,猪的器官都与人类极为接近。因此,选择猪作为异种器官移植供体成为国际共识。
但问题也随之而来,与狒狒相比,人类与猪的亲缘关系(生物学差异更大)明显更远,因而猪的器官也更容易被人体排斥,产生强烈的免疫排斥反应。不仅如此,PERV也是一个无法忽略的问题——这种病毒的序列存在于猪的DNA中,因而极有可能通过器官移植感染人类细胞。
其实,已经有科学家将猪胰腺细胞植入糖尿病患者体内了,而且并未发现PERV感染的迹象。但这些细胞首先是数量极少,其次是使用了相应的保护措施。这种情况与移植整个器官完全是两个概念。
除此之外,为了让人体不对猪器官产生排异,可能还需要使用抑制类药物,来阻止免疫系统攻击外来器官,可一旦人体免疫系统被抑制,PERV病毒将更容易对人类造成伤害。


幸运的是,科学家们迎来了“基因魔剪”CRISPR。带来本次突破的George Church和杨璐菡也是最早投身于基因编辑技术的开发人员,他们曾有一个想法:高效的CRISPR能否用于“引导”RNA和DNA切割酶针对猪细胞的全基因组进行精确编辑。
在2015年,他们共同创立了专注于器官移植的eGenesis公司,杨璐菡担任该公司的首席科学家。而早在攻读博士学位的过程中,杨璐菡就意识到器官移植对全人类的重要性。这位毕业于北京大学,并于哈佛大学获得了博士学位的80后姑娘曾表示:“我们希望这家公司(eGenesis)能创造出患者不需等待就可进行器官移植的新世界。”

同一年,他们使用CRISPR技术使猪基因组内62个PERV基因同时失活。这在当时被认为是通过CRISPR实现精确、广泛遗传改变最成功的例子。它也为人们带了希望:这一技术最
终可让猪器官适合于人体。
eGenesis公司2015年的研究成果属于细胞水平的试验。而现在,通过基因编辑工具CRISPR,eGenesis公司使猪胚胎中该病毒的25个拷贝全部失活,将这些胚胎植入母猪的体内后,健康小猪顺利诞生。目前,该公司已经通过这种方法获得了37只小猪,在4个月的观察中,这些小猪均发育正常且体内无病毒(活性)。
来自德国罗伯特·科赫研究所(Robert Koch Institute)研究所的病毒学家Joachim Denner一直在从事神秘的PERV测序相关研究,他表示:“如果这个消息属实,这将无疑具有极其重要的意义……但凡有可能敲除猪基因中的PERV病毒,我们应该毫不犹豫!”
 图丨eGenesis公司进行研发的策略
图丨eGenesis公司进行研发的策略
传统的基因编辑过程非常缓慢且漫长,敲除一个基因的两个拷贝常常需要几代猪的繁殖,如果需要加入人类基因,那么时间可能还要X2。来自马里兰大学医学院的外科教授Muhammad Mohiuddin认为,与传统的基因编辑相比,使用CRISPR技术同时对多个基因进行剪切可以节省大量的时间。他同时也是另一个异种器官移植项目的负责人(并未参与此项研究)。
值得注意的是,虽然这些病毒可能会感染人类组织,但目前并没有证据证明这会导致人类的健康问题。
“除了这些病毒,异种器官移植在临床应用上还有其他一些限制因素”, Mohiuddin说到,话意直指在动物器官移植过程中机体产生的免疫反应。杨璐菡也认为,要想这些基因编辑猪的器官在人体上试用,仍旧需要数年的等待。
也就是说,猪器官人体移植目前面临的两大问题分别是:一是猪的基因组内含有内源性逆转率病毒序列,可以感染人类;二是猪的器官在人体内会触发严重的免疫风暴,产生免疫排斥反应。
解决了前一个问题,后一个问题将是eGenesis公司需要攻克的下一个难关。接下来,eGenesis将继续使用CRISPR技术对免疫系统相关基因进行修饰。

图丨CRISPR-Cas9技术有望解决猪器官进行异种移植时面临的挑战
随着技术的突破,还有一个问题也逐渐浮现出来:这种技术上的重大跨越反而使得人们对异种器官移植心生恐惧。由于PERV病毒风险的不确定性,有人担心过度的编辑将会使得原有的器官发育过程变得更加复杂,而且美国FDA已经明确要求,在未来的人体实验中也必须使用无PERV病毒的猪。
阿拉巴马大学伯明翰分校的移植免疫学家大卫·库珀(David Cooper)说:“很显然,这些尚未解决的问题使得猪器官移植的道路变得更加的崎岖。”
杨璐菡个人简介


杨璐菡本科毕业于北京大学,并于哈佛大学获得了博士学位。在哈佛,她师从有“合成生物学之父”美誉的美国科学院与工程学院双料院士George Church教授,研究CRISPR-Cas9基因编辑系统。2011年至今,她已在《科学》、《Nature Communications》、《Nature Medicine》等杂志上发表了数十篇论文,最高单篇引用数超过了3000。
2017年入选世界经济论坛(World Economic Forum)评出的“全球青年领袖”。此外,她共同创立的生物技术公司eGenesis宣布获得了3800万美元的融资,并有望利用火热的CRISPR-Cas9基因编辑技术,攻克人类器官移植的难题。
(部分内容:DeepTech深科技(id:mit-tr))