奇点网 2018-05-20 07:37:12
疼痛,虽然令人不适,但它确实是一种人体保护机制。
不管是吸猫时手被猫咬了,还是出门时头被门挤了,我们都知道赶紧缩回来。
不仅如此,当病原物入侵时,相应部位的疼痛感也会很快让我们意识到,那里出问题了,要去看医生了。不过这个过程稍复杂。
在很长的一段时间里,科学家认为,入侵的病原菌被人体免疫细胞识别,免疫细胞在召集更多免疫细胞的时候,还会激活周围的痛觉神经细胞[1]。痛觉神经细胞一边把一线的战况汇报给最高指挥部大脑,一边分泌一些信号分子,在一定程度上控制免疫细胞的活性,避免它们变得像绿巨人浩克那样杀敌八百自损三千。

所以,病原菌入侵时,由免疫细胞引起的疼痛对人体也是一种保护。
不过,科学家也有想不明白的地方。
“噬肉菌”(化脓性链球菌,Streptococcus pyogenes)每年在全球范围内导致20万人死亡。这个菌有个奇葩的特点:相比于其他细菌感染,“噬肉菌”感染格外的疼,疼得让人难以忍受。所以在诊断“噬肉菌”引起的坏死性筋膜炎时,疼痛也是一个重要指标。
“噬肉菌”感染为什么那么疼?对“噬肉菌”的致病性有什么作用吗?
近日,哈佛医学院的Isaac Chiu博士(数学家丘成桐之子)团队揭开了这个谜团[2]。原来“噬肉菌”可以分泌一种毒素,这个毒素可以不经过免疫细胞直接激活痛觉神经元。
“噬肉菌”的这一举动产生了两个后果,一是让被感染者痛不欲生;二是被激活的痛觉神经元大量产生抑制免疫细胞的信号分子,导致人体免疫系统被抑制。简单的说就是,越疼免疫系统被抑制的越厉害。

Isaac Chiu博士
正是这个原因,让“噬肉菌”引起的坏死性筋膜炎杀伤力巨大,即使是在西方发达国家,坏死性筋膜炎的死亡率也高达32%[3]。
令人兴奋的是,Chiu博士不仅揭开了“噬肉菌”致疼的谜团,还找到了破解“噬肉菌”劫持神经系统抑制免疫系统的方法。已获FDA批准用于化妆品和偏头疼治疗的肉毒杆菌神经毒素A(BoNT / A),以及FDA正在审批的CGRP阻断剂(近日,FDA已经批准了Aimovig用于治疗偏头疼),就可以解除“噬肉菌”利用痛觉神经对免疫系统的抑制。
Chiu博士团队的这一重要发现,于近期发表在顶级期刊《细胞》上[2]。
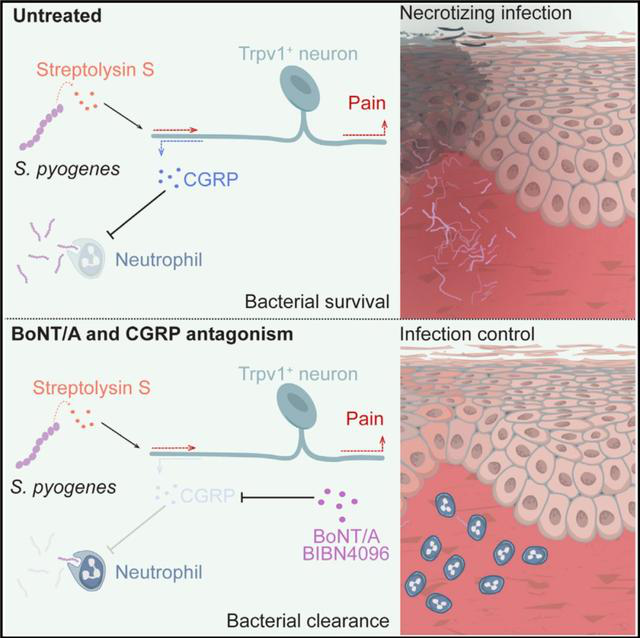
上图为“噬肉菌”激活痛觉神经元,产生CGRP抑制免疫细胞吞噬“噬肉菌”;
下图为痛觉神经元产生CGRP被阻断,免疫细胞吞噬“噬肉菌”
病原菌能劫持人体神经系统,这看上去有些不可思议。实际上在2012年之前,几乎没人会这样想。更不会有人想到病原菌竟可以通过让宿主感觉到疼,去抑制宿主的免疫系统。
2011年的某一天,免疫学博士Isaac Chiu和他的搭档Christian A. Von Hehn在研究感染过程中神经系统与免疫系统如何相互作用的时候,偶然发现一个奇怪的现象。
当他们往培养着免疫细胞和神经细胞的培养液中加入病原菌(当时他们的实验材料是金黄色葡萄球菌)的时候,神经细胞立即就感受到了细菌的存在。这应该是科学家第一次看到病原菌与神经细胞的互动。
在当时看来,这很神奇啊。
毕竟之前我们一直认为,病原物入侵后,先被免疫细胞识别,免疫细胞在识别病原物之后再通知神经元,被激活的神经元一方面给大脑传递信号,汇报被入侵的位置,同时释放一些信号蛋白,作用于免疫细胞,让它们悠着点,保持冷静克制。然后在这种动态的平衡中,实现消灭病原物,而不对身体造成更大的伤害。按理说,最先有反应的应该是免疫细胞才对。
这个现象,让Chiu博士和Von Hehn对病原菌与神经细胞之间的“互动”产生了兴趣。于是他们决定用金黄色葡萄球菌刺激下神经细胞一探究竟。
结果很让他们吃惊,金黄色葡萄球菌可以不通过免疫细胞,直接激活神经细胞调节疼痛和炎症。2013年8月,他们这项颠覆性研究成果发表在《自然》杂志上[4]。也就是这篇文章,开启了病原菌与神经系统互动的大门。
当时,Feinstein医学研究所的免疫学家和神经外科医生Kevin Tracey表示,这个研究最刺激的地方在于,“病原菌被神经系统感知到了”,而且它们之间有互动,这不是普通的化学物质致疼那么简单。
这个研究做完之后,Chiu博士脑子冒出的想法就是,金黄色葡萄球菌与神经系统之间的这种互动,与它的致病能力有关吗?很快他又启动了对这个问题的研究。
终于,他们在2017年证实,小鼠在感染金黄色葡萄球菌后,黄色葡萄球菌会“劫持”肺部感觉疼痛的神经元,促使痛觉感受器释放一种名为CGRP的神经肽,这种神经肽可以抑制肺召集中性粒细胞和γδT细胞等免疫细胞的能力。
他们还发现,仅通过清除感染部位的痛觉神经元,就可以使小鼠抗感染的能力增强10倍,让95%的感染致命肺炎的小鼠“不治自愈”,这项研究成果今年年初发表在《自然医学》上[5]。这个研究暗示,破除病原菌与神经系统的互动,可以解除病原菌对免疫系统的抑制,达到治疗感染的目的。
从时间上来看,Chiu团队本次发表在《细胞》上的“噬肉菌”研究与上面那个应该是同时进行的。这篇发表在《细胞》上的文章又往前迈出了一步,不仅机制阐释的更细致;更重要的是,研究人员真的找到了一种可以解除病原菌通过神经系统抑制免疫系统的方法,而且涉及的药物,有的已经获FDA批准,这无疑为这些药物快速进入临床应用打下坚实的理论基础。
Chiu团队的这一系列研究不仅揭示了感染、神经系统和免疫系统之间的复杂作用机制,也给感染,尤其是耐药菌的感染治疗提供了新见解,或许可以通过打破三者之间的互动,实现对耐药菌感染的治疗。
编辑神叨叨
虎父无犬子!


参考资料:
[1]. Pinhoribeiro F A, Verri W A, Chiu I M, et al. Nociceptor Sensory Neuron–Immune Interactions in Pain and Inflammation[J]. Trends in Immunology, 2017, 38(1): 5-19.
[2]. Felipe A. Pinho-Ribeiro, et al. Blocking Neuronal Signaling to Immune Cells Treats Streptococcal Invasive Infection[J]. Cell, 2018, 173: 1-15.
[3]. Cole J N, Barnett T C, Nizet V, et al. Molecular insight into invasive group A streptococcal disease[J]. Nature Reviews Microbiology, 2011, 9(10): 724-736.
[4]. Chiu I M, Heesters B A, Ghasemlou N, et al. Bacteria activate sensory neurons that modulate pain and inflammation[J]. Nature, 2013, 501(7465): 52-57.
[5]. Baral P, Umans B D, Li L, et al. Nociceptor sensory neurons suppress neutrophil and γδ T cell responses in bacterial lung infections and lethal pneumonia[J]. Nature medicine, 2018, 24(4): 417.