全基因组测序(Genome sequencing)已经发现了一种原发性免疫缺陷疾病(primary immunodeficiency disease)的遗传致病基础。
发现、并且开发出一款新型药物是一项非常艰辛的工作,这需要先在实验室(bench)里找到与某种疾病,比如肿瘤相关的分子异常,然后对这种异常分子的功能进行研究,再根据这个异常的分子设计、开发出一款相应的药物,最终通过临床试验的验证才能让这款新药走向临床,走进病人的床边(bedside)。这也就是一个标准的从试验台到病床的流程。很少有反过来(从病床边向试验台)的情况出现,即根据一大群患有同样疾病的患者的情况,收集到相关的突变数据,再根据这些突变开发出新药,即所谓的病床——试验台——病床模式。不过Angulo等人在《科学》(Science)杂志上发表了一篇文章,介绍了一次反向操作的成功经验,他们发现了一种遗传性的免疫缺陷病,而且同时还为这种疾病找到了可以立即使用的特效药。这项研究也显示出外显子组测序(exome sequencing)在发现罕见疾病致病突变方面的超强实力。
Angulo等人对7个家系里的17人进行了外显子组测序。这7个家系成员的表型各不相同,但是所有患病成员都有反复发作的呼吸道感染病史,以及脾大(splenomegaly)和进行性肺病(progressive lung disease)等症状。经过测序之后发现,这些患者都携带了同一个突变,即PIK3CD基因里第1021个氨基酸从谷氨酰胺变成了赖氨酸(E1021K)。PIK3CD基因编码p110δ蛋白,这是PI3K家族蛋白的一个催化亚基(catalytic subunit)。由于发生了E1021K突变,所以PI3K激酶出现了不恰当的活化,于是Angulo等人将这种疾病称作PI3Kδ活化综合征(activated PI3Kδ syndrome, APDS)。
IA型PI3K激酶是一种高度保守的激酶,它们能够磷酸化修饰膜脂质4,5二磷酸磷脂酰肌醇(phosphatidylinositol 4,5-bisphosphate)。这些异源二聚体激酶由一个p110催化亚单位和一个调控亚单位组成。其中催化亚单位有三种,分别是由PIK3CA、PIK3CB、PIK3CD这三种基因编码的p110α、p110β和p110δ;调控亚单位也有三种,分别是PIK3R1、PIK3R2或PIK3R3。其中p110α和p110β都是广泛表达的,而p110δ只见于血液细胞当中。PI3K激酶可以活化下游的细胞表面受体,根据不同的细胞、不同的PI3K异构体,以及相关的细胞信号可以行使促使细胞生长、增殖、生存、迁移、代谢、血管生成(angiogenesis)以及分化等多种不同的功能。
我们对PI3K家族功能的认识和了解离不开对小鼠实验动物,以及这些激酶亚单位发生突变的人类患者的研究工作。比如在小鼠实验中就发现,缺失了p110α和p110β都会带来致命性的后果,导致小鼠胚胎死亡,但是缺失了p110δ则只会表现出B细胞分化障碍,成熟B细胞和T细胞功能受损等表型。缺失了p110δ蛋白的小鼠血清里免疫球蛋白的含量会偏低,机体针对依赖或不依赖T细胞抗原(T cell–independent and T cell–dependent antigens)的抗体反应也会受到非常严重的抑制。如果小鼠缺失了Pik3r1基因编码的调控亚单位,也会造成类似的B细胞免疫缺陷等后果。也有报道称发现过一例PI3KR1基因纯合突变患者,该患者PI3KR1基因的5’端出现了一个提前终止突变,他就表现为无丙种球蛋白血症(agammaglobulinemia),以及B细胞完全不能发育。其症状和缺失了Pik3r1基因的试验小鼠非常相似,但是要比实验小鼠严重得多。
对人体肿瘤进行的遗传学研究也发现,大部分肿瘤细胞都携带有活化PI3K相关信号通路的突变。比如获得功能的(gain-of-function)突变PIK3CA基因或PIK3R1基因就是非常典型的例子。在巨脑(megalencephaly)和过度生长综合征(somatic overgrowth syndromes)患者的病变组织中也能够发现PIK3CA和PIK3R2突变活化基因。有意思的是,PIK3CA基因里有很多促癌突变都位于催化结构域编码区域里,而这个区域恰好和PIK3CD活化突变患者的一样。Angulo等人借助生化方法和细胞学试验证实,E1021K突变增强了p110δ亚单位的酶活性,同时也增强了该蛋白与细胞膜的联系。
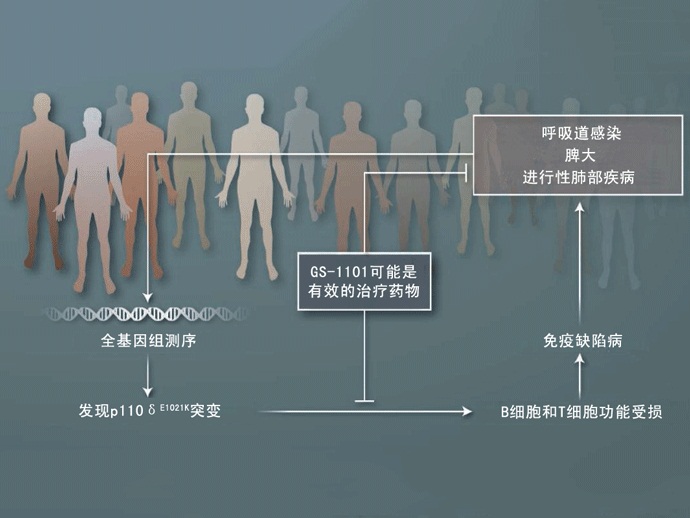
发现遗传疾病。科研人员在一群有着非常常见症状的患者中发现了一种共有的突变,那就是p110δE1021K突变。这种突变会使B细胞和T细胞功能受损,导致免疫缺陷病,这也就是最近发现的原发性免疫缺陷病APDS。在临床试验中发现,使用p110δ蛋白抑制剂GS-1101治疗慢性淋巴细胞性白血病(chronic lymphocytic leukemia)和非何杰金式淋巴瘤(non-Hodgkin’s lymphomas)都能够取得不错的疗效。p110δ蛋白抑制剂也被用来治疗一些炎症性疾病。APDS可能对这种药物也会非常敏感。
PIK3CD基因发生E1021K活化突变患者的临床表型有一些出人预料。这些患者最大的特点就是反复发作荚膜细菌(encapsulated bacteria)感染,但这是一个不那么特异性的发现。虽然这些患者血清里IgM(这是在感染之后第一个出现的抗体)的含量有时还有所增高,但是血清总IgG(亲和力最高的一种抗体)的水平还是正常的。血清里破伤风类毒素(tetanus toxoid,这是一种非常强的依赖T细胞的抗原)抗体的滴度也是正常的。不过对于肺炎链球菌(Streptococcus pneumoniae)和流感嗜血杆菌(Haemophilus influenzae)这类不依赖T细胞的抗原就不会产生太高滴度的抗体。缺失了Pik3cd基因的小鼠对于依赖或不依赖T细胞的抗原也不会产生非常明显的免疫反应,这说明只有在恰当的时间,出现恰当数量的p110δ蛋白才是保证机体拥有正常免疫功能的关键。
令人吃惊的是,这些患者进行性肺病的程度与其抗体滴度不相适应。有报道称中性粒细胞的正常功能也需要正常的p110δ蛋白活性,但是Angulo等人也没有在这些患者中观察到中性粒细胞功能缺失的情况。不过体外实验并不能真实的反映体内的情况。
有人可能会认为p110δ蛋白功能活化的患者患恶性肿瘤或者自身免疫病的机会会高一些。虽然也发现过这些情况,但是并不多见。这可能是因为这些患者的淋巴细胞因为蛋白活化而非常容易死亡。Angulo等人也注意到,在17名被检者中过度性B细胞(transitional B cell)的比例有所增加,这些细胞都是刚刚从骨髓中释放的。Angulo等人认为这种情况可能就是由于B细胞发育障碍或成熟B细胞死亡太多,但是也有可能是骨髓中前体B细胞生成增多所致。病变初期就开始出现脾大以及淋巴结肿大,然后再出现反复感染的现象也支持上面这种假设。在多个小型社区中都发现了这种新发现的APDS疾病患者,这也说明一定还有其他的医生手上有这种患者。实际上,最近在这7个家系里又发现了14个免疫缺陷患者,他们也都是PIK3CD基因出现了突变活化的。这项工作最让人兴奋的一点在于我们不仅发现了这种疾病,而且马上就可以对这些患者进行治疗了。已经发现,对于某些B细胞肿瘤患者,p110δ选择性抑制剂GS-1101对这种疾病具有非常好的治疗效果,而且患者的耐受性也非常好,目前这种药物的III期临床试验已经在进行之中。
GS-1101与另外一种相关的药物IC87114都能够阻断E1021K突变体的活性,另外IC87114也能够对T细胞起到保护作用,不至于因为激酶活化而死亡(activation-induced cell death)。这些药物是否能够恢复患者的免疫功能,阻止器官的损伤也是一个值得研究的问题。从更广泛的层面来说,这种酶可能还是白血球过多症(leukemia)、免疫缺陷以及炎症等多种疾病的共同药物作用靶点。
原文检索:
Mary Ellen Conley, David A. Fruman.Can Cancer Drugs Treat Immunodeficiency?.Science, 15 November 2013;DOI:10.1126/science.1246760